软件介绍
编辑点评:用来学好化学的必备应用
非常适合学习化学的中学生和高中生,化学方程式app可以用来模拟做试验,更快更方便的学习化学方程式内容,还支持在线修改方程式及最全的元素周期表,想要复习化学的家长同学必备。

功能介绍
【五大模块】
“化学方程式”软件包含方程式、俗称、颜色、性质与周期表五大模块。每一模块紧密结合、相辅相成,可以很好的帮助同学们更全面学习与认知。
【软件宗旨】
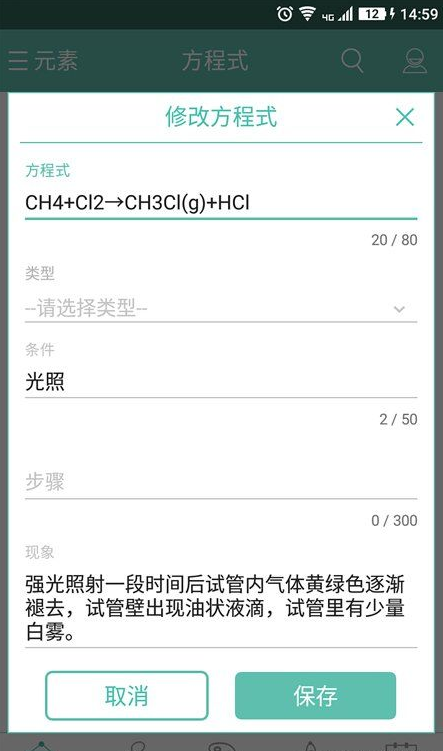
本软件一直致力于“为同学们提供最便捷、最齐全的化学查询工具”为宗旨,经过三年发展,数据也日趋完善,目前已经满足了初高中大部分同学的需求。本软件独特的搜索技术以及显示技术,可以帮助你迅速的找到你要查找的知识点,方便而快捷。
作者的话
化学是一门很神奇的学科,我们生活中的方方面面都离不开化学,化学的魅力之处在于她能够解释清楚我们所处环境中的各种现象与本质。本软件着眼点在课本,却高于课本。软件的精益求精也是我们一直奋斗的目标。希望本软件能够一直伴随同学们的学生生涯,给同学们带来学习上的便利。我与你们一起,共同探索、共同进步!
高中必背化学方程式
高一化学必修一化学方程式大全
1、钠在空气中燃烧(黄色的火焰)
2Na + O2==【点燃】Na2O2
钠块在空气中变暗
4Na+O2=2Na2O
Na2O在空气中加热(变黄)
2Na2O+O2=2Na2O2
2、钠与水反应(浮、熔、游、响、红)
2Na + 2H2O = 2NaOH + H2 ↑
2Na + 2H2O = 2Na+ + 2OH- + H2↑
3、过氧化钠与水的反应(放热反应、Na2O2是强氧化剂,用于漂白)
2Na2O2 + 2H2O = 4NaOH + O2 ↑
2Na2O2 + 2H2O = 4Na+ +4OH -+O2↑
碱性氧化物Na2O与水的反应
Na2O+H2O=2NaOH
4、过氧化钠可用在呼吸面具和潜水艇中作为氧气来源,原因是:
2Na2O2 + 2CO2 = 2Na2CO3 + O2
5、苏打(纯碱)与盐酸反应
①盐酸中滴加纯碱溶液
Na2CO3 + 2HCl = 2NaCl + H2O+CO2↑
CO32- + 2H+ = H2O + CO2↑
②纯碱溶液中滴加盐酸,至过量
Na2CO3 + HCl =NaHCO3 + NaCl
CO32- + H+ = HCO3-
NaHCO3+HCl=NaCl+H2O+CO2↑
HCO3-+H+ = H2O +CO2↑
6、小苏打受热分解
2NaHCO3==【加热】Na2CO3 + H2O +CO2 ↑
7、固体氢氧化钠和碳酸氢钠混合物在密闭容器中加热
NaHCO3 + NaOH==【加热】Na2CO3 + H2O
HCO3-+ OH - = H2O + CO32-
(若是溶液中反应有离子方程式)
8、金属锂在空气中燃烧
4Li + O2==【加热】2Li2O
9、氯气的性质
铜丝在氯气中剧烈燃烧(棕色烟)
Cu + Cl2==【点燃】CuCl2
之后加水,可由绿色溶液(浓)得到蓝色溶液(稀)
Cl2 +2FeCl2 =2FeCl3
2Cl2+2NaBr=2NaCl+Br2
Cl2 +2NaI =2NaCl+I2
Cl2+SO2 +2H2O=H2SO4 +2HCl
2Na + Cl2 ==【点燃】2NaCl
10、铁在氯气中剧烈燃烧 2Fe +3Cl2==【点燃】3FeCl3
11、氢气在氯气中燃烧(苍白色火焰)
H2 + Cl2==【点燃】2HCl
氟气与氢气反应(黑暗处即可爆炸)
H2+F2=2HF
12、氯气溶于水(新制氯水中含H+ 、Cl-、ClO-、OH-、Cl2、HClO、H2O)
Cl2 + H2O = HCl + HClO
Cl2 + H2O = H+ + Cl- + HClO
13、次氯酸见光分解(强氧化剂、杀菌消毒,漂白剂)
2HClO==【光照】2HCl + O2↑
14、工业制漂白粉的原理及漂白粉的失效
2Ca(OH)2 + 2Cl2 =Ca(ClO)2 + CaCl2 +2H2O
2Ca(OH)2 +2Cl2 =2Ca2++2ClO-+2Cl-+2H2O
Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO
2HClO==【光照】 2HCl + O2↑
Ca2-+2ClO-+ CO2 + H2O =CaCO3↓+ 2HClO
15、氯气的实验室制法:(仪器:分液漏斗,圆底烧瓶)
MnO2 +4HCl(浓)==【加热】 MnCl2+Cl2↑+2H2O
MnO2 +4H++2Cl-==【加热】Mn2++Cl2↑+2H2O
16、新制氯水注入盛溴化钠溶液的试管中
Cl2 + 2NaBr = Br2 + 2NaCl
Cl2 + 2Br- = Br2 + 2Cl-
17、铁与硫加热反应 Fe + S==【加热】FeS
铁与氧气加热反应 3Fe+2O2==【加热】Fe3O4
铁在氯气中加热反应 2Fe+3Cl2==【加热】2FeCl3
18、铜与浓硫酸反应: Cu+2H2SO4 (浓) ==【加热】CuSO4 +2H2O+SO2 ↑
19、碳与浓硫酸反应: C+2H2SO4(浓)==【加热】2H2O+CO2↑+2SO2↑
20、工业制单质硅(碳在高温下还原二氧化硅)
SiO2 + 2C=(高温)Si + 2CO↑
21、二氧化硅与氢氧化钠反应
SiO2 + 2NaOH = Na2SiO3 + H2O
SiO2 + 2OH+ = SiO32- + H2O
22、氮气和氢气反应(工业合成氨)
N2 + 3H2→【催化剂】 2NH3
2NH3→【高温高压】N2 + 3H2
23、氮气和氧气放电下反应(雷雨发庄稼)
N2 + O2=(放电)2NO
2NO + O2=2NO2
二氧化氮溶于水
3NO2 + H2O =2HNO3 + NO
3NO2 + H2O =2H++ 2NO3-+NO
24、HNO3与Fe的反应
Al、Fe遇浓HNO3、浓硫酸钝化(常温)
Fe与浓HNO3加热
Fe+6HNO3==【加热】 Fe(NO3)3+3NO2↑+3H2O
Fe与稀HNO3反应
Fe+4HNO3=Fe(NO3)3+NO↑+2H2O
3Fe+8HNO3=3Fe(NO3)2+2NO↑+4H2O
25、NO2 、O2 的混合气通入水中无剩余气体
4NO2 + O2 + 2H2O = 4 HNO3
26、NO 、O2 的混合气通入水中无剩余气体
4NO + 3O2 + 2H2O = 4 HNO3
27. 氨的催化氧化
4NH3 +5O2 ==【催化剂、加热】4NO + 6H2O
28. 碳酸氢铵受热分解
NH4HCO3==【加热】 NH3 ↑+ H2O↑ + CO2↑
29. 用浓盐酸检验氨气(白烟生成)
HCl + NH3 = NH4Cl
30. 硫酸铵溶液与氢氧化钠溶液混合加
(NH4)2SO4 +2NaOH==【加热】2NH3↑+Na2SO2 +2H2O
NH4+ + OH-==【加热】NH3 ↑+ H2O
31. 硝酸铵溶液与氢氧化钠溶液混合(不加热)
NH4NO3 + NaOH = NH3·H2O + NaNO3
NH4+ + OH- = NH3·H2O
32. 铝箔在氧气中剧烈燃烧
4Al + 3O2 ==2Al2O3
33. 铝片与稀盐酸反应
2Al + 6HCl = 2AlCl3 + 3H2↑
2Al + 6H+ = 2Al3+ +3H2↑
34. 铝与氢氧化钠溶液反应
2Al+2NaOH +2H2O = 2NaAlO2 +3H2↑
2Al + 2OH- +2H2O = 2AlO2- + 3H2↑
35. 铝与三氧化二铁高温下反应(铝热反应)
2Al + Fe2O3==【高温】 2Fe + Al2O3
36. 镁在二氧化碳中燃烧
2Mg + CO2 ==【点燃】2MgO + C
37. 氧化铝溶于氢氧化钠溶液
Al2O3 + 2NaOH = 2NaAlO2 +H2O
Al2O3 + 2OH- = 2AlO2- + H2O
38. 硫酸铝溶液中滴过量氨水
Al2(SO4)3 +6NH3·H2O=2Al(OH)3↓+(NH4)2SO4
Al3+ + 3 NH3·H2O = Al(OH)3↓+ 3NH4+
39. ①氢氧化铝溶液中加盐酸
Al(OH)3 + 3HCl = AlCl3 + 3H2O
Al(OH)3 + 3H+ = Al3+ + 3H2O
②Al(OH)3与NaOH溶液反应
Al(OH)3 + NaOH = NaAlO2 +2 H2O
Al(OH)3 + OH- = AlO2- +2 H2O
40. 高温下铁与水反应
3Fe + 4H2O(g)==【高温】 Fe3O4 + 4H2
41. 铁与盐酸反应
Fe + 2HCl = FeCl2 + H2↑
Fe + 2H+ = Fe2+ + H2↑
42. 氧化铁溶于盐酸中
Fe2O3 + 6HCl = 2FeCl3 + 3H2O
Fe2O3 + 6H+ = 2Fe3+ + 3H2O
43. 氯化铁中滴入氢氧化钠溶液(红褐色沉淀)
FeCl3 + 3NaOH = Fe(OH)3 ↓+3NaCl
Fe3+ + 3OH- = Fe(OH)3 ↓
44. 氢氧化亚铁在空气中被氧化(白色沉淀变为红褐色沉淀)
4Fe (OH)2 + O2 + 2H2O = 4Fe (OH)3
45. 氯化亚铁溶液中通入氯气
2FeCl2 + Cl2 = 2FeCl3
2 Fe2+ + Cl2 = 2 Fe3+ + 2Cl-
46. 氯化铁溶液中加入铁粉
2FeCl3 + Fe =3FeCl2
2Fe3++ Fe = 3Fe2+
47. 用KSCN检验Fe3+的存在离子方程式
Fe3++3SCN-= Fe(SCN)3
元素周期表规律
一、金属活动性顺序表:
金属活动性顺序由强至弱: K Ca na Mg Al Zn Fe Sn Pb(H)Cu Hg Ag Pt Au
(按顺序背诵) 钾 钙 钠 镁 铝 锌 铁 锡 铅 (氢) 铜 汞 银 铂 金
金属活动性顺序规律:
1.金属位置越靠前的活动性越强,越易失去电子变为离子,反应速率越快。
2.排在氢前面的金属能置换酸里的氢,排在氢后的金属不能置换酸里的氢,跟酸不反应。
3.排在前面的金属,能把排在后面的金属从它们的盐溶液里置换出来。排在后面的金属跟排在前面的金属的盐溶液不反应。
4.混合盐溶液与一种金属发生置换反应的顺序是“先远”“后近”。
注意:*单质铁在置换反应中总是变为+2价的亚铁。
例:判断金属活动性强弱
例3 、 有X、Y、Z三种金属,将三种金属分别放入稀硫酸中,Y溶解并放出氢气,X 、Z不溶解,将X浸入Z的硫酸盐溶液中,在X的表面有Z析出。则三种金属的活动性由强到弱的顺序是( )
A.Y、Z、X
B.Y、X、Z
C.X、Y、Z
D.Z、X、Y
解析:三种金属分别浸入稀硫酸中,Y溶解放出H2,X、Z不溶解,可推判在金属活动性顺序表中,Y排在H的前面,X、Z排在H的后面;将X浸入的Z硫酸盐溶液中,X能置换出Z,可判断X的活动性比Z的强,故选B。
二、元素周期表的规律
1.1 原子半径
(1)除第1周期外,其他周期元素(惰性气体元素除外)的原子半径随原子序数的递增而减小;
(2)同一族的元素从上到下,随电子层数增多,原子半径增大。
1.2 元素化合价
(1)除第1周期外,同周期从左到右,元素最高正价由碱金属+1递增到+7,非金属元素负价由碳族-4递增到-1(氟无正价,氧无+6价,除外);
(2)同一主族的元素的最高正价、负价均相同
1.3 单质的熔点
(1)同一周期元素随原子序数的递增,元素组成的金属单质的熔点递增,非金属单质的熔点递减;
(2)同一族元素从上到下,元素组成的金属单质的熔点递减,非金属单质的熔点递增
1.4 元素的金属性与非金属性
(1)同一周期的元素从左到右金属性递减,非金属性递增;
(2)同一主族元素从上到下金属性递增,非金属性递减。
1.5 最高价氧化物和水化物的酸碱性
元素的金属性越强,其最高价氧化物的水化物的碱性越强;元素的非金属性越强,最高价氧化物的水化物的酸性越强。
1.6 非金属气态氢化物
元素非金属性越强,气态氢化物越稳定。同周期非金属元素的非金属性越强,其气态氢化物水溶液一般酸性越强;同主族非金属元素的非金属性越强,其气态氢化物水溶液的酸性越弱。
1.7 单质的氧化性、还原性
一般元素的金属性越强,其单质的还原性越强,其氧化物的氧离子氧化性越弱;元素的非金属性越强,其单质的氧化性越强,其简单阴离子的还原性越弱。
例:元素周期表规律的考察
如图为元素周期表的一部分.下列说法不正确的是( )
A.钠、镁、铝三种原子的电子层都有3个层
B.氢、锂、钠三种原子的最外层都有1个电子
C.铍、镁两种原子易得到电子变成离子
D.图中有5种金属元素
试题解析:
A.钠、镁、铝三种原子位于第3周期,故核外都是三个电子层上有电子;故正确;
B.氢、锂、钠三种原子位于第一主族,最外层都有1个电子;
C.铍、镁两种原子的最外层有2个电子,故是易失去电子达到稳定结构;
D.根据元素名称可知图中锂、铍、钠、镁、铝5种金属元素.
答案:C.
上边我们通过了试题及其详细的讲解给我们同学讲解了金属活动性顺序表和元素周期表的规律,希望同学们下边多做相应试题,牢记这些规律,争取中考在次不失分。
更新日志
版本1.1.0.33
1、优化夜间模式
2、优化网络请求
3、优化资源加载
更新说明1.1.0.22
1、增加附录数据
2、优化权限授权
3、优化资源加载
1.1.0.17更新
1、优化打印功能
2、优化页面显示
3、优化提交功能
免责声明:本站所有软件均来源于网络,不推广不盈利,仅供学习使用,请24小时后删除,请支持正版,如有侵权,联系删除!qq 739051932信箱